

 |
 |
|
|
Навигация
Популярное
|
Публикации «Сигма-Тест» Гальванические покрытия в машиностроении 1 [ 2 ] 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 OBiUHE СПГЛГННЯ О КОР1011П1 Коррозионная стойкое п. металле с каюпал оиной коррозией состош в рациональном подборе коррознонио-стойких материалов и заи;итиых пс-крыти si. Газовая коррозия. Процесс, проте-каю1шп1 при взаимодействг.и металла с газами при высокой температуре, назыЕа]0т газовой коррозией. Этот вид )<орроз;и1 протекает по химическому механизму. Наиболее часто встречающийся процесс - окисление металлов в результате воздействия О со-держа[це,гося в воздухе. Для большинства практически важных мста.плсв оксидная пленка, являющаяся продуктом газовой корро-вни, образуется сплошной, и с ростом ее толщины наблюдается торможение ckhcieiuih. Зависимость толщины оксидной п.теик.н x от времени окисления т: хп - Кт, где К - константа; л - показатель, отражающий степень торможения процесса растущих слоев оксида. Медь (в температур}юы интервале 300-1000С) и железо (500-1000 X) окислякяся по параболическому ва-кону (п 2). Меры борьбы с газовой коррозией сводятся к подбору соответствующего металла, применению термодиффузионного насыщения алюминием, кремнием, хромом или нанесению ;каростойкого металлического (напри>:ер, хромового) или неметаллического (например, жаростойкой 5ыал1.) покрытия. Радиационная коррозия. Радиоактивное из.тучение (нейтроны, протоны, дейтроны, а- и -частицы, f-излучсние) оказывает существениое влиянне на протекание коррозиоииы.ч процессов. Радиоактивное нзл>чсиие, пе изменяя принципиа.11ьио ме.\а1;изм коррозии, оказывает влияние иа кинетику коррозионных процессов. Изменение скорости коррозионного процесса (ДМ под дейстиием излучсгпя явлйетеи функцией трех эффектов; Радиолизиый эффект 5ii обусловлен воздейстснем облучения иа коррозионную среду, прежде всего на воду. Образующиеся при радио.гшзс воды HiOj. О3 и радикалы Oi I н HOj являются энергичными катодными деполяризаторами. Поэтому радиолиз- ный эффек! зскоряет катодный процесс. Это в основном характерно для металлов, не имеющих на своей поверхности толстых оксидных пленок. Деструктирующий эффект 5д обусловлен упругим и тепловым взаиис-дейстеием поверхности металла с облучающими частицами, что приводит к появлению дефектов в поверхностном слое металла и оксидной пленки. Деструктирующий эффектособениоопа-сен для металлов, корроаиониая стой кость которых обусловлена boshhk-ковением фазовых аашитнь:х слоев (оксидных плег.ок). Эффект 5д способствует облегчению протекания анодного процесса. Фоторадиационный аффект 5ф ва-ключается в изменении полупроводниковых свойств оксидных и других поверхностных пленок. По сравнению с 5р и Зд фото радиационный эффект мало влияет на скорость коррозии. КОРРОЗИОННАЯ СТОЙКОСТЬ МЕТАЛЛОВ Коррозионная стойкость металлов оценивается с помощью специальных шкал стойкости, в том числе - десятн-балльр.ой (табл. 9). В табл. 10 приведены сведения, показывающие коррозионные гютери различных метв.т-лов при коррезионном токе 1 ыкА/см, а б табл. 11 снеденкя о коррозии в различных ра исках СССР. е. десйтнбал.1Ь1ая шка.ча корроч!ониой стойкости
Пашые о коррозионной стойкости мллое в различных средах првв( дены в табл. 12 к 13 in Скорост* коррозия при П.10Т1ШСТВ ;,ро % иого тока 1 мкА с - Продолжгчие таГ5л Ю
i плспт HOC lb i атиона Скоросп IvOPpOSHi: ri, 08 0,2,1 0 50 0,S7 0,29 0,11 0,26 0.97 0 29 0.63 0.27 0,004 0,012 0,021 0,023 0,012 0,023 0,011 0.034 0.015 0,021 0.013 II. Величина коррозии в ичных районах за период продолжительностью 100 . Москва, ромышлен -иая атмосфера Fe Cd zn Си AI 15.5 1.55 0.8 0,4 1.97 o.ie 0,11 0.04 0.04 Количество ионов CI мг/(м -сут ) Количество SOe. мг/м 0,214 CeLiep, морская атмосфера иенигород, сельская атмосфера
0.65 0,1 0,15 0.05 0,89 0.07 0,06 11,02 0.02 0.0133 0,18 0,0107 Батуми, s алоз;;гряз-исиная тг.<1сф*>ра 0,55 0,20 0,05 1,14 0.10 0.08 0.02 0,02 0.005S 12. Ко;?озвониая стойкость кета.1лов в кислотах и щелочах
HNO,
н,во.
Стоек 0,004 10 10 2.8 2.2 3.7 3 Продолжение табл. 12 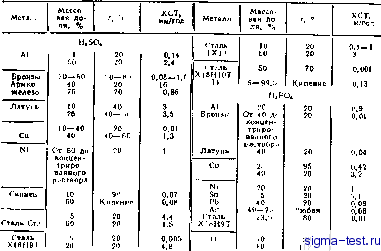 А1 Бронз I. Сталь Ста Х13 Сталь xeihiot Or (rtc-крытие) Zn Бронзы Латуиь Си 3.5-35 10-35 ?а-30 10 1,6 0.5 Любая Любая От 90 до кипения 20-40 80 80 20- I 00 70 20 70 20 100 100 20 20 СН.СООН Сталь углеродистая
10 2.5-15 10 3 2, ев 0,1 - 0,3 17,8 11.5 1.6,* 62.6 0,11 0,05-0.5 2,49 0.5-7 0.45 0,16 0,72 6 0.007 1,34 А1 Броьэы Армко-желеэо Сталь СтЗ Сталь XlfciiJT 40 20-4 0 ксиц. 40-60 48 40-00 20 20-100 15 20 20 20 20 20 hjcro. Сталь 1X13 Концеи-триро-ваииыЬ раствор Любая .S0-60 20 20 Любая 20 100 Кипение А1 N1 10 Насыщенный раствор 0,75 70-80 20 0.12 Нестоек 15,40 0,06-1.5 0.08 0,08 0.23 0.08 13 5.8 0,28 0.94 Стоек 0,1 10 1,49 0,1 0.001 Продолжение табл. 12 Металл Массовая доля, % хст. мм/год Н.С.О. Сталь Сй Сталь 1X13 Т1 Д1 Бронзы н латуни Си Любая 6,3 10-50 0.6. Лк>6ая Кипение NaOH Любая 0,5-35 Любая 20-100 20-80 Нестоек 0,41 10 Массовая доля. % i, °С NaOH 0,13 0,05-1.0 0,001 - 0,06 0.00] Sn РЬ Сталь СтЗ Сталь 1X13 Сталь Х18Н10Т 0,8 Концентрированный раствор 310 г/л 20 200 г/л 620 г/л 20 100 60 20 100 100-140 Кипение Э. Коррозионная стойкость металлов в морской оде Алюминиевые сплавы типа АМг и АМц Бронзы, латуни Армко-Бкелезо Си N1 VOpCKOfi воды (. °с Любая Сннтетн-ческая Любая Синтетическая 20 20 20-60 20 20 20 ХСТ, мм/год Тип морской воды Темпера- Нестоек 0,003- 0,0в 0,001 - 0,01 0.07 Стоек 0,1
ХСТ мм/год 0,07 0,1 0,09 0.18- 0,65 0,25 хст, мм/год Глава химия в табл. I приведены атомные но мера, Балеитиисть .и атомная масса элементов, Коииентрация растворенных в воде вен1СС1В выражается: числом грамм-эквивалентов вещества Л, растворенного и 1 л раствора (нормальность); чис.чом граммов вещества С, растворенного в 1 л раствора, г/л; числом граммов вещества Р, растворенного в 100 г раствора, %. Пересчет концентрации Р, выраженной в %, на концентрацию С в г/л производится по формуле С = Рр-10, где р - плотность, г/см. Пересчет концентрации Л, выраженной в нормальности, иа концентрацию С в г/л Производится по формуле где М - молекулярная масса; г - вален тиость. В 1абл 2-5 представлены завнсимости между концентрацией и плот-H0CT1 ю растворов иекотсрь;х химикатов. Б табл. 6 приведеЕЫ да1!ные о процентном содержании нета,11лов в их солях и окислах для наиболее часю применяемых в гальванотехнике ве-щссик Ъсктрохимия. в табл. 7 приведен],! стандар1иые электродные потенциалы металлоп в водных растворах при температуре 25 С. ЗначеП1я электрохимических эквивалентов нек<яорих элементов приведены в табл, 8. В табл, 9 Приведены згятчсиия постоянных а к b е урависпии Тафеля. Электрокристаллизацня. Процесс влектрокристаллизации состоит из следующих стадий, 1) переноса разряжа- ОБЩЕТЕХМИЧБСКИЕ СВЕДЕНИЯ юшихся ПОПОВ из объема электролита к поверхности электрода: йены проходят через диф()1узиониый слой к наружной границе диффузной части двойного электрического слоя; 2) перехода ионов на границе фаз со сторо1:ы электролита к металлу; происходит частичная десольватация металлических ионов, прохождение их через двойной электрический слой и превращение (разряд) ионов в адсорбированные ноны (ад-ионы) и атомы (ад-атомы); на этой стад)1н происходит собственно электрохимическая реакция, при которой ионы, частично теряя сольват-ную или гидратную оболочку, адсорбируются поверхностью электрода и нейтрализуются электронами; 3) диф--фузии ад-атомов (ад-ионов) по новерх-иостн электрода к местам роста и построения кристаллической решетки (образование двух- и трехмерных зародышей, внедрение атомов в кристаллическую реи;етку). Последнюю стадию, происходящую иа поверхности металла, можно представить как суммарный процесс распределения гдеорбнрованных атсмов в решетке л:е1аллическнх кристал.чсв. При этом рассматриваются два предельных сл\чая. В первом случае металлические ионы проходят двойной электрический слон в любом месте поверхности, разряжаются и в виде :дсор6и рованиых атомов Д11ф([,уиди-.уют к местам роста н распределяются там в решетке. Во втором случае мета ллическт:с иоьы поступают непосредственно к местам роста иа катоде, ()Л овремеико восстанавливаются и распределяются в решетке. Предполагается, что во втором случае подхсд металлических попов нс-посредствеиио к местам роста с одно-врсмеиним внедрением нейтральных атомов в кристаллическую решетку ,. Атомные номера, ва.,еч, ность атомиаи иасса элементов \тс>мная ,cca Азот Алюминий Барий Бериллий Б рои Ванадий Бнсмут Бодород Вольфрам Железо Золото Индв* Иридий Калий Кальций Кислород Кобальт Кремний Магний Марганец Медь Молибден Мышьяк
2; 3 2; 4 2; 4 2; 4 4; 6: 7 3; 2 2 3; 4; 6; 8 2; 4 2; 4 2; 4; 6 31 5 6 2; 3; 4 - i 4; 6 3; 5 l; 5; 7 2; 3; 6 г. Соотношение плотности н концентрации водных растворов кислот прн 20 °С Плотность, г/с л, * Лд-ноим- ие полностью неетра.тизо-ванные. частично де ндратнрованные ионь:. 1.00 1,01 1.02 1,03 1.04 1.05 1,00 1.07 1,08 1.09 1.10 1.12 1.14 1.16 1,18 1,19 1.20 1,25 1,30 1.40 1,45 1,60 1.60 1.70 1.83 Концентрация, мае. доля, % UNO, H,SO, 0,36 2,36 4,39 6.43 8,49 10,52 12.51 14,50 16,47 IS, 43 20.40 24,25 28.18 32.14 36.23 38,32 1,33 2,16 3,98 5,78 7,53 9,26 10.97 12,65 14,31 15.05 17,60 20.80 23.94 27,00 30,00 31.47 32,94 40,58 48.42 07,00 79.43 96.73 0.2!. 1,73 3,24 4,75 6,24 7,70 9.13 10,66 12.00 13.30 14.70 17,43 20,13 22.60 26,20 26.50 27,70 33.82 39,70 50,50 55.45 60.17 69,09 77.63 87,70 Н,РО, 0,30 2,15 4,00 5.84 7,64 9,43 11,19 12,92 14,60 16.26 17,87 21,03 24.07 27,05 30,00 31.35 32.76 39,49 45.88 57.54 62,96 68,10 77.60 BG.38 94.57 11.33 3.0 в; о 10,1 14.8 17,6 20,0 22.9 2,-.,0 30.0 36.0 43.0 1,20 8.14 15,40 23,10 31.06 40.20 53.40 80.00 22,98 58,71 118,69 106,40 195,09 186,21 102,91 200,59 101,07 207,19 78,93 32.00 107,67 87.02 121,75 181,95 17.90 12,01 238,03 30.97 18.99 33.45 51,99 65,37 ll.CrO, 11,45 1.9 1,0 6.5 7,1 6,0 9.5 П.З 12.0 12.6 15,8 18,4 19,0 23,1 23,8 V4.U зо.о 34.5 44,0 40.! 50,0 (.4.5 ь5,2
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© 2010 www.sigma-test.ru Санкт-Петербург: +7 (812) 265-34-48, +7 (812) 567-94-10
Разработка и поддержка сайта: +7(495)795-01-39 после гудка 148651, sigma-test.ru(my_love_dog)r01-service.ru Копирование текстовой и графической информации разрешено при наличии ссылки. |