

 |
 |
|
|
Навигация
Популярное
|
Публикации «Сигма-Тест» Метод вакуумного напыления 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 [ 42 ] 43 44 45 46 47 48 49 50 51 52 53 54 генциал образцов аморфного сплава измерялся относительно потенциала эталона, которым служил стандартный насыщенный каломельный электрод. Своеобразие поляризационных кривых данного аморфного сплава состоит, во-первых, в том, что отсутствует активное состояние - потенциал коррозии лежит в окрестности О В. Это соответствует потенциалу пассивации чистого хрома. Следовательно, в кислых водных растворах таких, как 2н. H2SO4 или в нейтральных водных растворах, как 1 н. NaCl, данный аморфный сплав под воздействием растворенного кислорода самопасаивируется. Во-вторых, в широкой области потенциалов вплоть до потенциала перепассивации электрический ток пассивации крайне мал, что свидетельствует о высоких защитных свойствах образующейся пленш. В-третьих, при II 10
/1о/пен1/ищв Рис. 9.6. Потенциостатические поляризационные кривые аморфного сплава Fe-ЮСг-13Р-7С в 1 н. водном растворе NaCl и 2 н. водном растворе HaSOi 10 S
0 5 15 го 25 ZT,°/o(arn.] Рис. 9.7. Влияние хрома и молибдена на самопассивацию аморфных сплавов Fe-Сг-Мо - Металлоид в растворах соляной кислоты при различных температурах (сплавы, расположенные правее границы, пассивированы; сплавы, расположенные левее границы, находятся в активном состоянии): ;--2 н. раствор, 20°С; 2 -6 н. раствор, 20°С; 3 - 9 н. раствор, 20°С; 4-12 н. раствор, 20°С; 5 - 6 н. раствор, 80°С; 6--12 н. раствор, 60°С; 7-9 н. раствор, 80°С; S -6 н. раствор, 80°С; 9 - 12 н. раствор, 20°С - - ------ (потенциал 3 на рис. 9.5) не обнаруживается внезапного повышения электрического тока. Это хорошо видно также на поляризационных кривых, полученных для случая 1 н. водного раствора НС1 (см. рис. 9.8), которые весьма схожи с кривыми на рис. 9.6. Обычно потенциал питтинговой коррозии кристаллических сплавов железо -хром повышается с увеличением содержания хрома, при этом электрический ток за счет пе-репассивации хрома также повышается, а питтинговая коррозия не появляется при содержании хрома в сплаве >28% (по массе) [7]. Однако в кристаллических сплавах железо -хром, даже при увеличении концентрации хрома до 100% самопроизвольной пассивации в 1 н. водном растворе нет, при этом обязательно выявляется активное состояние. Среди используемых в настоящее время кристаллических металлов только в тантале в результате самоНассивации не возникает питтинговая коррозия, например, в 1 н. водном растворе НС1 при ком- натной температуре. Та же ситуация наблюдается в рассматриваемом аморфном сплаве Fe - Сг - Р - С, что позволяет говорить о его превосходной коррозионной стойкости. Из известных сейчас материалов наилучшей коррозионной стойкостью обладают аморфные сплавы Fe-Сг - Мо - Металлоид. Сплавы, легированные хромом и молибденом, даже в 1 н. НС1 при повышенных температурах самопассивируются и почти не корродируют. На рис. 9.7 приведены данные, показывающие, при каких концентрациях хрома и молибдена происходит самопассивация аморфных сплавов Fe - Сг - Мо - Металлоид в растворах соляной кислоты различной концентрации и при различных температурах. Этот рисунок довольно наглядно иллюстрирует происходящую в наши дни переоценку возможностей коррозионностойких материалов. 9.2.2. Аморфные сплавы на основе кобальта и никеля Аморфные сплавы, содержащие определенные количества хрома, имеют высокую коррозионную стойкость, причем это касается не только сплавов на железной основе, но и сплавов на основе кобальта и никеля. На рис. 9.8 показано, как изменяется скорость 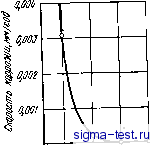 к,%(т 0 3 5 7 9 Рис. 9.8. Влияние хрома {х) и металлоидов на скорость коррозии в 1 н. водном растворе НС1 аморфных сплавов на основе железа, кобальта и никеля: 7 -Ni-хСг -20Р; 2 -Со - *Сг-13Р -7С; 3 -Fe -хСг- 13Р -7С; 4 -Ni-хСг -20В; 5 -Со -хСг -20В; tf -Fe - хСг -20 В Рис. 9.9. Влияние хрома на скорость коррозии аморфных сплавов Ni-Сг-ISP-SB при 30°С в 10%-ном водном растворе FeCl3-6h20 коррозии аморфных сплавов на основе железа, кобальта и никеля при легировании их хромом в 1 н, НС1 [9]. В целом, введение хрома действует благоприятно, но в количественном отношении это зависит от сорта металлоида. Наиболее эффективным является добав- ление хрома в сплавы, содержащие фосфор. Ниже мы подробно остановимся на причинах этого явления. На рис. 9.9 показано, как в зависимости от содержания хрома изменяется скорость коррозии аморфных сплавов Ni - Сг -15 Р - 5 В в водном растворе 10% Ре01з-6 НаО [10]. Этот раствор часто применяется в экспериментах по щелевой коррозии аморфных сплавов на железной основе. Нержавеющая сталь 18 Сг - 8 Ni хорошо изученная в кристаллическом состоянии, имеет склонность к сильной щелевой коррозии; в указанном выше растворе средняя скорость коррозии здесь достигает 10 мм в год. В аморфных сплавах на кобальтовой и никелевой основах, где питтииговая коррозия Рис. 9.10. Потеициостатические кривые анодной поляризации аморфных сплавов Ni-Сг-15Р-5В в 1 н. водном растворе НС1 и в 2 н. водном растворе H2SO4: / -Ni - 50Сг - 15Р - 5В, 2 н. H2SO4; 2-Ni-7Cr-15P -5В, 2 и. H2SO4; 3 -N1 -9Сг-ISP-SB, 2 и. H2SO4; 4 -Ni -7Сг - 15Р-5В, 1 н. НС1; 5-Ni - 0-0,2 qii 0,6 OiS 1,0 1,2 1,i< 1,6 1,8 9Cr- 15P -5В, 1 н. HCl Ло/птоищВ возникает примерно в тех же условиях, что и в аморфных сплавах на основе железа, при введении хрома скорость коррозии значительно уменьшается. Потеициостатические поляризационные кривые аморфного сплава Ni - Сг- 15 Р - 5 В в 2 н. водном растворе H2SO4 и в 1 н. водном растворе НС1 представлены на рис. 9.10 [10]. В обоих растворах этот сплав самопассивируется. Также как и в случае аморфных сплавов на основе железа, здесь питтииговая коррозия не возникает в I н. водном растворе НС1 даже при высоких потенциалах. Аморфный сплав Со - Сг - 13 Р - 7 В при содержании ~ 10% (ат.) Сг также самопассивируется в 1 н. водном растворе НС1 [11]. При добавлении в аморфные сплавы на кобальтовой и никелевой основах, кроме хрома, других металлических элементов наблюдаются примерно те же тенденции, что и в случае аморфных сплавов на основе железа. 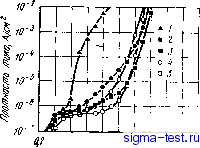 9.2.3. Аморфные сплавы типа металл-металл Сплавы типа металл-металл в аморфном состоянии также имеют более высокую коррозионную стойкость, чем в кристаллическом состоянии. Пример для сплава Zr-50 Си приведен на рис. 9.11 [12]. Из сравнения скоростей коррозии этого сплава в кристаллическом й аморфном состояниях в 1 н. водном растворе НС1 видно, что в первом случае скорость коррозии примерно в два раза выше, чем во втором. Интересно, однако, что скорость коррозии чистой кри- сталлической меди в 1 н. водном растворе НС1 составляет 0,6 мм/тод, а чистый кристаллический цирконий почти не корродирует. Таким образом, скорость коррозии аморфных сплавов металл-металл в данной среде выше, чем скорость коррозии чистых кристаллических металлов, образующих данный сплав. Практически отсутствуют сведения о том, что коррозионная стойкость сплавов металл-металл в аморфном состоянии выше, чем коррозионная стойкость простых кристаллических металлов, формирующих сплав. В случае же аморфных сплавов типа металл металлоид, как отмечалось раньше, при добавлении соответствующих металлов сплав приобретает высокую коррозионную стойкость, которая выше, чем коррозионная стойкость простых кристаллических металлов, входящих в данный сплав. 0,05 що,оз 0,01 □ 1 iH.HjSO, iH.HNOj tH.NaOH J%Naa W.HCI Рис. 9.11. Скорость коррозии кристаллического (i) и аморфного (2) сплавов Zr-50Cu в различных водных растворах -Ц5 О 0,5 (О 1,5 2,0 2,5 ПотШ-а/1, В Рис. 9.12. Потенциодинамиче-ские кривые анодной поляризации аморфных сплавов Ti-50Си (/) и Ti-45Си-5Р (2) в 1 н. водном растворе НС1 Аморфные сплавы типа металл-металл обычно имеют гораздо более высокую коррозионную стойкость, чем кристаллические сплавы того же химического состава, причем коррозионная стойкость сплава определяется главным образом коррозионной стойкостью и концентрацией компонентов. Что касается двойных аморфных сплавов, содержащих кремний, то по коррозионной стойкости их скорее можно отнести к сплавам типа металл-металл, чем к сплавам типа металл-металлоид. Например, в двойных сплавах Fe-Si, приготовленных методом распыления, при увеличении концентрации кремния от 20 до 30% (ат.), также как и в кристаллических сплавах, скорость коррозии в разбавленной серной кислоте снижается примерно в 50 раз. Когда содержание кремния превышает 25% (ат.), можно методом распыления получить аморфные сплавы, скорость коррозии которых будет примерно в десять раз меньше, чем скорость коррозии кри- сталлического сплава такого же химического состава [13]. Такил! образом, сплавы Fe - Si в аморфном состоянии имеют значительно более высокую коррозионную стойкость, чем в кристаллическом состоянии, причем крайне важным является здесь повышенное содержание кремния. Аморфные сплавы Pd - Si также имеют высокую коррозионную стойкость, характерную для аморфных структур вообще. Так как эти сплавы обычно содержат большие количества кремния, в них легко образуется защитная пленка [14]. Коррозионное поведение аморфных сплавов типа металл-металл коренным образом меняется при добавлении даже небольших количеств металлоидов. На рис. 9.12 показаны поляризационные кривые аморфных сплавов Ti- 50 Си и Ti - 45 Си - 5 Р, полученные в 1 н. водном растворе НС1 [12]. При введении в аморфный сплав Ti - Си всего лишь 5% (ат.) фосфора в 1 н. водном растворе НС1 происходит самопассивация, электрический ток становится ниже тока пассивации кристаллического титана в таком же растворе. Таким образом, металлоиды играют важную роль в улучшении коррозионной стойкости аморфных сплавов. Ниже мы рассмотрим причины этого. 9.3. ПРИЧИНЫ ВЫСОКОЙ КОРРОЗИОННОЙ СТОЙКОСТИ АМОРФНЫХ СПЛАВОВ 9.3.1. Образование пассивирующей пленки Известно, что высокая коррозионная стойкость в различных средах достигается благодаря тому, что металл переходит в пассивное состояние. Это касается и аморфных, и кристаллических сплавов, содержащих хром, в частности нержавеющих сталей. В чистых кислотах, не содержащих таких сильноокисляющих ионов, как хлорид-ионы, например в водных растворах серной кислоты, катодная поляризация приводит к тому, что нержавеющая сталь переходит внассивноесостояние. На рис. 9.13 представлены результаты рентгеновской фотоэлектронной спектроскопии (РФС) чистого кристаллического железа и двойных сплавов Fe - Сг, пассивированных в 2 н. водном растворе h2so4 [15]. На этом рисунке показано отношение концентрации хрома в пассивирующей пленке и концентрации хрома на поверхности сплава непосредственно под пленкой к средней концентрации хрома в сплаве [Сг]/(Сг]--[Ре]). Хорошо известно, что хромистая сталь становится нержавеющей при содержании хрома 130 (ат.) и более. Как ясно из рисунка, в пассивирующей пленке, возникающей на поверхности нержавеющей стали, скапливаются значительные количества хрома. В этой пассивирующей пленке содержатся также О-, ОН и Н2О. Если главный компонент пассивирующей пленки, возникающей на поверхности стали с пониженным содержанием хрома, может быть выражен как (Fe , Реб )-Ог,- (ОН)2о-1-зь-2г/-Н20, то главный ком-258 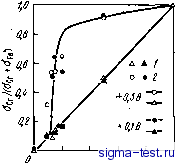 понент пленки на поверхности нержавеющей стали можно описать как СгОх(ОН)з-2л:- Н20. Эти компоненты в любом случае являются оксидами-гидроксидами, однако количество Н2О и соотношение между содержащимися в них ионами О- и ОН- различаются в зависимости от химического состава сплава и условий образования пленки. Накопление хрома в пассивирующих пленках также происходит и в случае аморфных сплавов, содержащих хром. Поскольку аморфные сплавы окисляются слабее, чем стали, то неудивительно, что при низких потенциалах, отвечающих пассивному состоянию, хром накапливается в пассивирующих пленках, образующихся на поверхности аморфных сплавов. С повышением концентрации xipoMa в сплаве повышается и его концентрация в пассивирующей пленке, при этом коррозионная стойкость сплава улучшается. Таким ббразом, пассивирующая пленка, состоящая главным образом из гидратированного оксида-гидрооксида хрома, по своим защитным свойствам превосходит пассивирующую пленку из гидрати. рованного оксида-гидрооксида железа. Если концентрация гидратированного оксида-гидрооксида хрома в пассивирующей пленке повышается, то улучшаются и защитные свойства такой пленки. В случае кристаллических сплавов на железной основе, в которых содержание хрома не превышает 13% (ат.), при пассивации не происходит накопления хрома в поверхностной пленке. При этом сплав не имеет и достаточной коррозионной стойкости. В аморфных же сплавах, напротив, даже при невысоком содержании хрома (как, например, в сплаве Fe - 3 Сг - 13 Р-7 С) в пассивирующей пленке содержится >507о Сг, что является одной из особенностей этих сплавов [16]. Следовательно, при введении в аморфный сплав даже небольших количеств хрома концентрация его в поверхностной пассивирующей пленке обычно становится высокой. Установлено, что аморфные сплавы Fe - 10 Сг- 13 Р -7 С [17], Со - 10 Сг - 20 Р ,[18] и Ni - 9 Сг - 15 Р - 5 В [10] самопассивируются в 1 н. водном растворе НС1. Напротив, ферритная нержавеющая сталь самопроизвольно не пассивируется в 1 н. водном растворе НС1, но пассивируется при анодной поляризации. Максимальные концентрации положительных ионов хрома в пассивирую- 0,2 0,к 0,6 0,8 f,0 Шержоние хрома Рис. 9.13. Влияние содержания хрома в сплаве на концентрацию хрома в пленке и непосредственно под пленкой, образующейся в двойных кристаллических сплавах Fe-Сг в 2н. водном растворе H2SO4 при по-тенциостатической поляризациг при потенциалах 0,1 и 0,5 В в течение 1 ч: I - концентрация атомов хрома непосредствеино под пленкой; 2 - концентрация катионов хрома в пленке
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© 2010 www.sigma-test.ru Санкт-Петербург: +7 (812) 265-34-48, +7 (812) 567-94-10
Разработка и поддержка сайта: +7(495)795-01-39 после гудка 148651, sigma-test.ru(my_love_dog)r01-service.ru Копирование текстовой и графической информации разрешено при наличии ссылки. |