

 |
 |
|
|
Навигация
Популярное
|
Публикации «Сигма-Тест» Метод вакуумного напыления 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 [ 43 ] 44 45 46 47 48 49 50 51 52 53 54 щих пленках при самопассивации выщеуказанных аморфных сплавов и при анодной поляризации ферритных нержавеющих сталей в 1 н. НС1 приведены ниже: [Сг +] / [Сгз*]+,[яоны других металлов] Аморфные СПЛ9ВЫ: Fe-10СГ--13Р -7С .... 0,97 Со-ЮСг -20Р 0,95 Ni -9Сг-15Р -5В ..... 0,74 Феррнтные нержавеющие стали: Fe -30 Сг 0,76 Fe-19Cr.......... 0,Й8 Интересно, что при пониженном содержании хрома в аморфном сплаве облегчается его накопление в поверхностной пассивирующей пленке, а это способствует повышению защитных характеристик пассивирующей пленки/. 9.3.2. Ускоренное формирование пассивирующей пленки Особенности аморфных сплавов типа металл-металлоид Как уже говорилось, аморфные сплавы типа металл-металлоид, не содержащие второго металлического элемента, обычно имеют довольно высокую скорость коррозии, превышающую скорость коррозии простых кристаллических металлов, используемых в качестве основы сплава. Однако при добавлении второго металлического элемента коррозионная стойкость этих сплавов существенно повышается, чему способствует легко возникающая защитная пленка. Классический пример этого показан на рис. 9.14 [19]. Здесь представлены изменения электрического тока во времени при измерениях на образцах аморфного сплава Pd - Ti - Р при высоком понтециале; образцы помещали в подогретый водный раствор NaCl с низ-ким рН. В результате коррозионного растворения образуется газообразный хлор по реакции 2С1- = С12-Ь2е. (9.6) Одновременно по реакции, обратной (9.3), происходит также выделение газообразного кислорода. Вначале анодный электрический ток чрезвычайно велик. В течение этого времени происходит активное растворение и газ не выделяется. Однако внезапно электрический ток снижается и одновременно практически прекращается растворение. При этом начи- Авторы последовательно развивают концепцию образования соверщенно!! пассивирующей пленки, обладающей высокими защитными свойствами вследствие накопления в ней хрома при избирательном растворении железа. Однако и другие факторы, по-видимому, могут быть причиной высокой коррозионной стойкости аморфных сплавов, содержащих хром [И, 43, 44]*. В частности, в [461* приводятся данные о том, что толщина пассииирующей пленки в сплаве Ре-Ni- Р-В при фиксированных потенциалах пассивной области в растворе NaCl может составить всего 0,1-0,2 А, т. е. меньще моиослоя. Прим. ред. 260 нает выделяться газообразный хлор. Прекращение растворений происходит из-за образования пассивирующей пленки. Однако благодаря необычайно сильной коррозии и действию хлора пассивирующая пленка понемногу начинает нарушаться, а электрический ток, соответственно, повышается. В конце концов, пассивирующая пленка разрушается, происходит повторное активное растворение сплава и одновременно прекращается выделение газа. Таким образом, процесс Kopj розни этого аморфного сплава в данной среде происходит в следующей последо-вательности: активное растворение-vtnac-сивация (выделение газообразного хло-ра)- -наруш€вие пассивирующей плен- ки->разрушение пассивирующей пленки (активное растворение) и т. д. Интересно, что хотя в начальный период за счет действия хлора пассивпру ющая пленка разрушается, активное растворение все равно восстанавливает пассивное состояние. Обобщая, можно сказать, что в сильных коррозионных средах активное растворение является важным условием образования пассивирующей пленки. При циклическом возникновении пассивирующей пленки в сильных окислительных средах активное растворение сплава приводит к тому, что растворяются те же элементы, которые почти не влияют на формирование пленки, а элементы, влияние которых существенно, напротив, не растворяются, но скапливаются у поверхности раздела с водным раствором, улучшая тем самым защитные свойства пленки. Следовательно, если в сплавах, содержащих такие элементы, как хром, которые способствуют образованию пассивирующей пленки и улучшают ее защитные свойства, скорость активного растворения повышается, то указанные элементы накапливаются у поверхности раздела, причем их накопление ускоряется, а это, в свою очередь, ускоряет и формирование пассивирующей пленки. Как указывалось ранее, в аморфных сплавах типа металл-металлоид возникают стабильные поверхностные пленки. Так, в аморфном сплаве Fe - 10 Сг - 13Р - 7С и кристаллической нержавеющей стали 18 Сг- 8 Ni в водном растворе 2 и. H2SO4 пассивирующая пленка возникает при довольно высоком потенциале. Устранить эту пленку можно механической полировкой внешней поверхности. В случае аморфного сплава сразу после полирования электрический ток, т. е. скорость активного растворения чистой внешней поверхности существенно возрастает [20]. После этого ско- 4 6 в Ю 1Z Время, м1/Н Рис. 9.14. Временные изменения электрического тока в аморфном сплаве Pd- 16Ti-19Р при постоянном потенциале 1,5 В в 4 и. водном растворе NaCl (рН 1,5) при 80°С: I - активное состояние; 2 - пассивация; 3 -разрушение пленки при образовании газообразного хлора рость растворения снижается благодаря тому, что хром быстро скапливается у поверхности раздела сплав/раствор и за короткое время аморфный сплав переходит в пассивное состояние. Вследствие дальнейшего постепенного увеличения концентрации хрома в пассивирующей шлейке ее защитные свойства улучшаются и скорость растворения постепенно все более понижается. Таким образом, в аморфных сплавах типа металл-металлоид из-за высокой химической активности, способствующей быстрому достижению в пассивирующей пленке высокой концентрации элементов, эффективно влияющих на ее защитные свойства, формирование пассивирующей пленки происходит довольно быстро. Это обстоятельство является одной из причин того, почему аморфные сплавы металл-металлоид имеют высокую коррозионную стойкость. Влияние химической активности основного металла Коррозионная стойкость аморфных сплавов металл-металлоид довольно сильно различа[ется в зависимости от типа основы, что хорошо видно из рис. 9.8. Ниже мы увидим, что повысить коррозионную стойкость за счет введения хрома в шлавы, содержащие только бор или фосфор в качестве аморфизатора, не очень легко. На рис. 9.8 приведены значения скорости коррозии аморфных сплавов Fe -Сг - 20 В, Со-Сг -20 В и Ni -Сг -20 В в 1 н. водном растворе НС1. На этих сплавах при содержании хрома <30% (ат.) стабильная пассивирующая пленка в данном растворе не возникает. Из трех элементов - Fe, Со, Ni - химически наиболее активно железо. Поэтому аморфный сплав на железной основе Fe - €г -20 В при содержании хрома <30% <ат.) имеет наибольшую скорость коррозии. Напротив, сплав на основе наименее активного элемента - никеля имеет и наиболее низкую скорость коррозии. Однако, если содержание хрома >30% (ат.), то сплав на основе железа самопассивируется благодаря легкому накоплению хрома на поверхности раздела раствор/металл. Так, при содержании хрома 35% (ат.) коррозия не наблюдается. В сплавах на основе менее химически активного кобальта картина иная. Активное растворение сплава на основе кобальта протекает менее интенсивно, чем активное растворение сплава на основе железа, и поэтому здесь слабее выражено накопление хрома на поверхности раздела сплава и раствора. Чтобы свести к нулю коррозию аморфного сплава на основе Со - Сг - 20 В в 1 н. водном растворе НС1, нужно добавить 50% (ат.) Сг. Таким образом, влияние химической активности основного элемента аморфных сплавов типа металл-металлоид сводится к следующему. Если сплав не содержит достаточного (оно зависит от химической активности металлической основы) количества элементов, способствующих образованию эффективной пассивирующей пленки, то скорость коррозии увеличивается. Если же концентрация таких элементов достаточна, то скорость коррозии сплава быстро снижа- ется, пассивация облегчается и защитные характеристики .образующейся пассивирующей пленки повышаются. Влияние металлоидов Металлоиды оказывают большое влияние на химическую активность вышеописанных аморфных сплавов металл-металлоид, что-выражается в изменении скоростей формирования пассивирующей пленки и накопления в ней элементов. Примеры такого влияния на коррозионную стойкость аморфных сплавов Fe - Сг приведены н рис. 9.15 [21]. В этих сплавах общее суммарное содержание хрома и металлоидов постоянно, при этом основным металлоидом служит или фосфор, или бор, к которым добавляется 7% (ат.) металлоида другого сорта. 2а 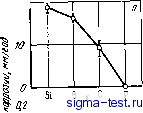 Рис. 9.15. Влияние металлоидов (X) иа скорость коррозии аморфных сплавов Fe-ЮСг-13В- ix (а) и Fe-lOCr-13Р- ix (б) в 0,1 и. водном растворе H2SO4 при 30°С 0,2 О (12 0,4- 0,5 (1в f,0 /,г Рис. 9.16. Влияние металлоидов (М) на кривые аноднов поляризации аморфных сплавов Fe-ZdCr-xMo-yM ъ 6 н. водном растворе НС1 при 80°Сг / -ЮМо -20В; 2-ЮМо - 13В -7Si; 3- 15Мо- 13В- 7Si; 4-ЮМо-18С; 5 - ЮМо-13Р -7G Даже на первый взгляд видно, что скорость коррозии сплавов, содержащих фосфор в качестве основного металлоида, более чем на два порядка ниже, чем скорость коррозии сплавов, имеющих в качестве основного металлоида бор. В этих сплавах скорость коррозии последовательно уменьшается, если вторым металлоидом являются Si, В, С, Р. Наличие фосфора наилучшим образом сказывается на повышении коррозионной стойкости аморфных сплавов Fe-Сг. Это относится не только к коррозии в слабых кислотах при обычных температурах, но и к коррозии в концентрированных кислотах при высоких температурах. На рис. 9.16 представлены поляризационные кривые, полученные при катодной поляризации аморфных сплавов iFe-Сг-Мо с различными металлоидами при 80°С в 6 н. растворе НС1 [8]. Сплав -Ре-25Сг-ЮМо-13Р-7С самопассивируется, его потенциал коррозии высок, а плотность тока пассивации низка. У сплава Fe-25Сг-ЮМо-18С в случае анодной поляризации потенциал коррозии ниже, а плотность тока пассивации несколько выше, чем у сплава, содержащего фосфор. Сплавы Fe-25Сг-Мо-13В-7С самопроизвольно не пассивируются при содержании молибдена до 15% (эт.). Это относится также и к сплаву Fe-25Сг-ЮМо-20В, где с увеличением концентраций молибдена и хрома самопассивация отсутствует. Таким образом, у аморфных сплавов, содержащих фосфор в качестве основного металлоидного элемента, обеспечивающего высокую коррозионную стойкость, последняя снижается в ряду С, Si, В в качестве второго металлоида. Обычно указывают на два фактора влияния металлоидных элементов на коррозионную стойкость аморфных сплавов металл - металлоид. Во-первых, это влияние металлоидов на скорость образования пассивирующей пленки. На рис. 9.17 приведены данные о скорости формирования пассивирующей пленки в аморфных сплавах, указанных ранее на рис. 9.15, в которых в качестве основного металлоидного элемента присутствует бор. На этом рисунке представлены результаты измерений плотности анодного электрического тока на образцах трех сплавов Fe-ЮСг-13В-ТХ в области потенциалов пассивации в 0,1 н. водном растворе H2SO4 после механической полировки поверхности. По этим данным можно оценить скорость активного растворения и скорость образования пленки. Начальному моменту времени соответствует плотность тока, измеренная непосредственно после прекращения полировки, т. е. эта плотность тока характеризует скорость активного растворения чистой поверхности сплава. Сплавы, содержащие фосфор, растворяются наиболее интенсивно и пассивация в них наиболее ускорена. Как уже отмечалось, быстрое активное растворение аморфных сплавов, содержащих фосфор, способствует накоплению хрома на поверхности раздела сплав/раствор, в результате чего ускоряется формирование пассивирующей пленки с большим содержанием хрома. Углерод и кремний оказывают меньшее воздействие на ускорение активного растворения сплава. Влияние углерода и кремния на величину концентрации хромав пленке и скорость ее образования также гораздо слабее, чем влияние фосфора. Другой фактор влияния металлоидов на коррозионную стойкость аморфных сплавов связан с изменением типа аниона в образующейся пассивирующей пленке. В качестве примеров рассмотрим аморфные сплавы Со-Сг-20В и Со-Сг-20Р. На рис. 9.18 показано, как изменяются потенциодинамические кривые анодной поляризации сплава Со-Сг-20В в 1 и. водном растворе HCI в зависимости от содержания хрома [11J. Потенциодинамические кривые, в отличие от потенциостатических, снимаются, когда потенциал материала непрерывно повышается от потенциала коррозии. Эти кривые показывают относительные изменения плотности тока. Плотность тока, определенная потенциодинамическим методом, не постоянна, что делает этот метод удобным средством для сравнения коррозионного поведения различных материалов. 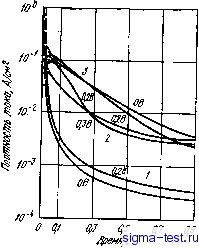
Рис. 9.17. Измеиеиие плотности тока анодной поляризации аморфных сплавов Fe-ЮСг-13В-71 в 0,1 и. водном растворе Нг504 после механической полировки поверхности: i -Fe-10 Сг -13 В-7 Р; 2 - Fe-10 Сг -,13 В -7 С; 3 - Fe-10 Сг-13 В -7 Si 0,5 О 0,5 f,0 ПотещищЗ Рис. 9.18. Потеицардииамические кривые анодной полиризации аморфных сплавов Со-Сг-20В . в 1 и. водном растворе НС1 / -ЗОСг; 2 -40Сг; 3 - Со- 25Сг-20В; 4 - 45Сг; 5 - Со- 50Сг-20В; 5 -Со-20В; 7 -Со- 20Сг-20В Сплавы, содержащие до 25% (ат.) Сг, имеют низкий потенциал коррозии, который в дальнейшем повышается. После активного растворения наступает пассивация. В сплавах, имеющих >3б% (ат.) Сг, благодаря самопассивации в этом водном растворе, активное растворение не проявляется. В работе [22] методом РФС проводится анализ химического состава поверхностной пленки, возникающей в рассматриваемых сплавах при естественной коррозии. Результаты этого анализа следующие: сплав Со -20Сг-20 В: (CoisCrJJIs)! (во7 )о,47 С128 0:з (ОН- )о,б4 0,92Н,О; сплав Со - 25 Сг - 20 В: в Зак. 307!
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© 2010 www.sigma-test.ru Санкт-Петербург: +7 (812) 265-34-48, +7 (812) 567-94-10
Разработка и поддержка сайта: +7(495)795-01-39 после гудка 148651, sigma-test.ru(my_love_dog)r01-service.ru Копирование текстовой и графической информации разрешено при наличии ссылки. |