

 |
 |
|
|
Навигация
Популярное
|
Публикации «Сигма-Тест» Метод вакуумного напыления 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 [ 45 ] 46 47 48 49 50 51 52 53 54 фактически пленка препятствует протекаиию коррозии. Поэтому образование пленки из продуктов коррозии сопровождается снижением тока активного растворения сплава, содержащего активные легирующие элементы, и повышением потенциала коррозии. Защитные свойства пленки из химических проду-ктов коррозии сильно изменяются в зависимости от концентрации в ней легирующих металлов. Величина этой концентрации определяет также изменения скорости коррозии и потенциала активного растворения. Влияние на формирование пассивирующей пленки Влияние активных легирующих металлов на процесс образования пассивирующей пленки отличается от того влияния, которое они оказывают на процесс активного растворения. Хром и титан в сильных средах окисляются при более высоком потенциале, чем железо, кобальт или никель, являющиеся основами сплавов типа металл - металлоид, и при своем охлаждении образуют пассивирующиеся пленки с высокими защитными характеристиками. В сплавах, содержащих хром и титан, пассивация наступает только тогда, когда концентрация хрома и (или) титана в образующейся поверхностной пленке превышает определенную величину. Это подтверждается и результатами анализа химического состава пленки, возникающей на поверхности аморфного сплава Со-Сг-20В при различном содержании хрома. В отличие от этого, ванадий, молибден и вольфрам при высоких потенциалах переходят в состояние перепассивации и поэтому они почти не содержатся в пассивирующих пленках сплавов, легированных этими металлами. Это видно из рис. 9.22 - в области высоких потенциалов, соответствующих пассивному состоянию, например сплава Fe-Мо-13Р-7С, молибдена в пассивирующей пленке почти нет. Следовательно, пассивирующая пленка, возникающая на поверхности аморфных сплавов железо-металлоид, легированных ванадием, молибденом или вольфрамом, представляет собой гидратированный окспд - гиДрооксид железа, т. е. она такая же, как и пассивирующая пленка кристаллического железа, образующаяся при анодной поляризации в серной кислоте. Все же указанное легирование способствует пассивации сплавов. Аморфные сплавы железо - металлоид, содержащие молибден, пассивируются так, как схематично показано на рис. 9.23. Уже говорилось, что для пассивации сплавов в сильных окисляющих ередах необходимо протекание процесса активного растворе-йия. При высоких потенциалах в сильно кислых средах активное растворение ускоряется, что уско]ряет и образование пленки из химических продуктов такого растворения. В этой пленке происходит накопление молибдена так, как это описано в предыдущем разделе. Пленка из химических продуктов коррозии является барьером, уменьшающим скорость растворения сплава, и поэтому она способствует формированию пассивирующей пленки - гидратиро- ванного оксида - гидроксида железа - между ею и поверхностью сплава. Ток растворения снижается за счет пассивации, в результате чего накопление молибдена, протекающее за счет активного растворения, и формирование пленки из химических продуктов коррозии прекращается. Однако пленка, которая успела образо- Рис. 9.23. Схема пассивации аморфных сплавов Fe-Мо - Металлоид в кислых водных растворах: 7 -скорость растворения; 2 - химические соединения молибдена; 3 - пассивирующая пленка FeOjc (ОН) пНгО; 4 - сплав   ваться и которая состоит из химических продуктов коррозии, содержащих молибден, нестабильна и переходит в раствор. Таким образом, активные легирующие металлические элементы способствуют пассивации аморфных сплавов, хотя сами и не образуют пассивирующей пленки. В противоположность аморфным сплавам, бинарные кристаллические сплавы железо - молибден в 1 н. водном растворе НС1 не пассивируются даже при высоких потенциалах. Это происходит потому, что кристаллические сплавы железа, в отличие от аморфных сплавов железо - металлоид, не обладают высокой скоростью активного растворения, достаточной для накопления молибдена в пленке из химических продуктов коррозии. Это накопление молибдена протекает очень трудно, а поскольку кристаллические сплавы в химическом отношении существенно неоднородны и имеют много участков, облегчающих коррозию, они слабо защищены химическими продуктами коррозии. . При введении в аморфные сплавы, наряду с хромом, который сам по себе способствует образованию превосходной пассивирующей пленки одновременно таких активных элементов, как ванадий, ниобий, молибден или вольфрам, формирование пассивирующей пленки - гидратированного оксида-гидрооксида хрома - облегчается. Воздействие этих элементов эффективно не только в случае аморфного состояния. Так, сопротивление коррозии нержавеющей стали значительно повышается при добавлении в нее молибдена. Поскольку перечисленные выше металлы перепассивируются при высоких потенциалах, сами они не образуют пассивирующих пленок как в случае коррозии в активном состоянии, так и на этапе формирования пассивирующей пленки, состоящей из гидратирован-ных оксидов-гидрооксидов. Следовательно, если эти элементы содержатся в сплаве в избытке, то они. за счет своей неустойчивости могут проникать в пассивирующую пленку, снижая тем самым ее защитные свойства [28]. 9.4.2. Случай, когда легирующие элементы менее активны, чем ОСНОВНОЙ металл При добавлении металлических элементов менее активных, чем элемент основы, скорость коррозии аморфных сплавов типа металл-металлоид также снижается, но в основе этого лежат совсем другие причины. Благодаря особенностям аморфной структуры неактивные элементы, например благородные металлы, равномерно распределяются в сплаве и его химическая активность понижается. В этом случае неактивные легирующие металлические элементы также почти не проникают в образующуюся пленку, а накапливаются в поверхностном слое металла непосредственно под пленкой из химических продуктов коррозии. Это хорошо видно по результатам анализа химического состава непосредственно под пленкой, образующейся на поверхности образцов аморфных сплавов Fe-13Р-7С, содержащих различные благородные металлы, после коррозии в 0,1 и. водном растворе НС (рис. 9.24). Приведенные данные показывают, что благородный металл накапливается в поверхностном слое металла, примыкающем к пленке, при этом сплав становится все менее активным, а скорость растворения снижается. Таким образом, при добавлении в достаточном количестве химически неактивных элементов скорость коррозии аморфных сплавов заметно падает. Поэтому один из путей повышения коррозионной стойкости аморфных сплавов состоит в легировании их, в частности благородными металлами.
--1/1,0 Рис. 9.24. Данные РФС по хи-ьгическому составу поверхностных пленок в аморфных сплавах Fe-lONi-13Р-7С (;), Fe-5Pt-13Р-7С (2) и Fe- lOPd-13Р-7С {S) при поляризации в течение 1 ч в 0,1 н. водном растворе H2SO4: / - исходное состояние сплава до поляризации 9.5. МЕСТНАЯ КОРРОЗИЯ Когда коррозия предпочтительно протекает на определенных участках поверхности материала, свойства материала в целом ухудшаются, а само явление-носит название местной коррозии. Описанная выше питтинговая коррозия является типичным примером местной коррозии. Развитие местной коррозии на поверхности обычного металлического материала происходит в местах, где имеются поры, поверхностные неровности, загрязнения и т. п. Как уже говорилось, коррозия металлических материалов развивается за счет анодной [уравнение (9.2)] и катодной (9.3) реакций в условиях их равновесия. Поры, загрязнения, трещины, выбоины на поверхности металлических материалов служат участками усиленно- 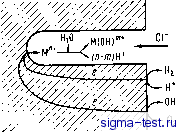 Рис. 9.25. Схема развития пит- тинговой коррозии: Л1 + - ион растворенного металла; М (ОН) + - составной нон металла, содержащий гид-роксильную группу ОН го растворения металла по сравнению с остальной поверхностью. Как показывает схема на рис. 9.25, при растворении металла.внутри трещин кислород сразу расходуется в результате реакции растворения. Это приводит к тому, что вокруг трещины и на участках поверхности, далеких от трещины, происходит перераспределение жидкости, в результате чего протекает только катодная реакция. Вследствие растворения металла на внутренней поверхности трещины положительные ионы накапливаются в жидкости и в ней нейтрализуются. Затем эти нейтрализованные ионы перемещаются во внешний раствор, откуда в трещину втягиваются сильные анионы, например хлорид-ионы. Кроме того, часть растворенных ионов металла реагирует с водой, в результате чего образуются гидрооксиды или положительные ионы, содержащие гидроксильные группы, а в растворе появляются ионы водорода. Таким образом, внутри трещины концентрация хлорид ионов или других сильных отрицательных ионов повышается, а так как концентрация ионов водорода велика (низкий рН), коррозионное растворение все более и более усиливается и свойства металла ухудшаются. Протекание местной коррозии затрудняет оценки ресурсов стойкости металлических материалов, которые обычно деллются из предположения, что материал одинаково корродирует на всей поверхности, поэтому изучение местной коррозии представляет собой важную с практической точки зрения .проблему. О том, что в сильных кислотах, содержащих, например, хлорид ионы, аморфные металлы даже при высоких потенциалах не подвергаются питтинговой коррозии, мы уже упоминали при рассмотрении поведения некоторых сплавов. Кристаллические двойные сплавы железо - молибден в 1 и. водном растворе НС1 переходят в пассивное состояние (см. рис. 9.21) с образованием пассивирующей п.енки, состоящей из гидратированного оксида-гидрооксида железа, и даже при высоких потенциалах питтинговая коррозия здесь не протекает. Уже говорилось о том, что пассивирующая пленка из гидратированного оксида-гидрооксида железа образуется и в кристаллическом железе. Однако железо сильно корродирует и в нейтральных водных растворах NaCl, не говоря уже о таком растворе как 1 и. НС1. Поэтому кристаллические сплавы Fe-Мо обычно приводят как пример сплавов с сильной питтинговой коррозией. Как уже было сказано ранее, поверхность кристаллических веществ в химическом отношении неоднородна и в некоторых ее участках образование пассивирующей пленки затруднено. На таких участках поверхности кристаллических сплавов легко возникает питтииговая коррозия. Поверхность аморфных сплавов не имеет таких участков, так как аморфные сплавы химически однородны и поэтому, естественно, характеризуются высоким сопротивлением питтинговой коррозии. Однако нельзя утверждать, что все аморфные сплавы вообще не подвержены щелевой коррозии. Так, после холодной прокаГки аморфных сплавов Ni-Fe-Ст,-Р-В на нх поверхности возникают многочисленные мелкие складки. В тех местах, где эти складки пересекаются друг с другом, возникают щели и другие подобные дефекты и поэтому, например, в водных растворах NaCI здесь может протекать щелевая коррозия. При высоких потенциалах в материалах, склонных к щелевой коррозии, электрический - ток снижается [33]. При протекании щелевой коррозии электрический ток быстро увеличивается в процессе поляризации при высоких потенциалах. В аморфных сплавах в случае возникновения щелевой коррозии электрический ток, за счет анодной поляризации при высоких потенциалах, уменьшается и даже на внутренней поверхности щелей легко образуется пассивирующая пленка. На внешней поверхности сплава происходит повторная пассивация (репассивация) и щелевая коррозия замедляется. Обычно эксперименты по щелевой коррозии проводят следующим образом. На поверхности аморфного сплава с помощью тефлона наносятся искусственные щели, после чего в процессе коррозионного растворения в водном растворе NaCI при высоком потенциале измеряют электрический ток. Однако этот ток ослабевает за весьма короткое время, так как аморфные сплавы даже при пали- чии щелей легко репассивируются [33, 34]. Мы уже подчеркивали, что аморфные сплавы, являясь химически однородными, практически не подвержены местной коррозии, в частности, питтинговой коррозии. Благодаря тому, что на поверхности аморфных лент быстро образуется пассивирующая пленка, протекание щелевой коррозии на искусственных царапинах тормозится за счет ускоренной репассивации. Это существенно затрудняет получение корректных оценок, однако и является основной причиной высокого сопротивления аморфных сплавов щелевой коррозии. 9.6. КОРРОЗИОННОЕ РАСТРЕСКИВАНИЕ И ВОДОРОДНОЕ ОХРУПЧИВАНИЕ На поверхности обычных кристаллических материалов таких, как нержавеющие стали, образуется внешняя пленка, предохраняющая материал от коррозии. Однако если к металлу, находящемуся в. коррозионной среде, приложить растягивающую нагрузку, то вследствие протекания пластической деформации скольжением на поверхности появляются участки, где пленка отсутствует, что облегчает коррозию на этих участках. В свою очередь коррозия вызывает появление микротрещин, где происходит концентрация напряжений, что инициирует пластическую деформацию. Поскольку процесс активного растворения локализован в пределах этих участков, остальная поверхность сохраняет металлический блеск и влияние коррозии внешне почти не проявляется. Разрушение металла проходит именно по тем участкам, где протекает коррозия. Это явление называется коррозионным растрескиванием. Оно, таким образом, происходит в результате комбинированного действия напряжений и коррозии. Коррозионное растрескивание приводит к крайне серьезному ухудшению свойств, поскольку оно может возникать даже пр* растягивающих напряжениях, составляющих менее одной десятой от напряжения разрушения в отсутствии коррозионной среды. Коррозионное растрескивание протекает за счет развития скольжения по кристаллографическим плоскостям. Поскольку в аморфных структурах нет кристаллографических плоскостей, разрушение в процессе активного растворения при приложении растягивающих напряжений (коррозия под напряжением) не обнаруживается,. Однако различные аморфные сплавы при приложении растягивающих напряжений в условиях коррозионной среды разрушаются при низких нагрузках, что Связано с охрупчиванием за счет водорода, образующегося в результате коррозии. Катодная реакция (9.5) может быть детально описана следующим образом: Н+ (в растворе) -fe (в металле) = Над 2 Над = На (газ). а также (а.7) (9.8) (9.9) ад + Н+ (в растворе) + е (в металле) = На (газ). Здесь Над - атомарный водород, адсорбированный внешней поверхностью металла. Он составляет некоторую часть от всего водорода, образовавшегося при восстановлении ионов водорода на внешней поверхности металла: Над :г Наб. (9.10) где Наб - водород, абсорбированный металлом. Абсорбированный водород охрупчивает металлические материалы, т. е. вызывает их разрушение при напряжении, гораздо более низком, чем предел прочности в отсутствии водорода. Это явление и носит название водородного охрупчивания. Такое охрупчивание довольно легко происходит в высокопрочных материалах, например в высокопрочных сталях. При естественной коррозии, когда скорость коррозии (т. е. скорость активного растворения) велика, велико и количество водорода, образующегося по реакции (9.5), что способствует водородному охрупчиванию. На рис. 9.26 представлена зависимость напряжения разрушения аморфного сплава Fe-23Ni-7,5Сг-13Р-7С от потенциала 1 Надо предполагать, что имеются в виду напряжения, ие превышающие предела текучести. Прим. ред. 2 Нельзя искли>чить из рассмотрения также роль локального анодного активирования и соответственно локального наводороживаиия. Прим. ред.
|
|
© 2010 www.sigma-test.ru Санкт-Петербург: +7 (812) 265-34-48, +7 (812) 567-94-10
Разработка и поддержка сайта: +7(495)795-01-39 после гудка 148651, sigma-test.ru(my_love_dog)r01-service.ru Копирование текстовой и графической информации разрешено при наличии ссылки. |