

 |
 |
|
|
Навигация
Популярное
|
Публикации «Сигма-Тест» Метод вакуумного напыления 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 [ 46 ] 47 48 49 50 51 52 53 54 при анодной или катодной поляризации в трех различных водных растворах серной кислоты {35]. По оси ординат отложено отношение предела прочности в растворе к пределу прочности на воздухе. Скорость растяжения во всех случаях одинакова. Низкие .значения предела прочности соответствуют высокой степени охрупчивания при испытаниях на растяжение в водных растворах серной кислоты. В случае катодной поляризации реакция (9.5) протекает бурно и, следовательно, количество абсорбированного водорода по реакции (9.10) довольно велико. В результате оказывается, что в случае катодной поляризации при испытаниях на растяжение при отрицательном потенциале количество абсорбированного водорода растет, что облегчает водородное охрупчивание и приводит к снижению прочности. 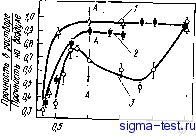 О 0,5 1,0 Потен vow, В Рис. 9.26. Изменения прочности, вызванные водородным охрупчиванием аморфного сплава Fe- 23Ni-7,5Сг-13Р-7С. в 2 и. водном растворе HaS04 (/), 5 н. водном растворе HaS04. (2) ив водном растворе 5 н. НгЗОл-ЬО,! н. NaCl в зависимости от потенциала поляризации (скорость деформации растяжения 5,6-.10-s с-): А - потенциал коррозии Ц5 О Время до разрушения 1нин IV 1с1/т -п - / *- 3 о- э- 5 й- S 10 10 10 10 Время доftuspi/a/emff,;? Рис. 9.27. Зависимость времени до разрушения аморфных сплавов Fe-Мо-Сг - Металлоид в 1 н. водном растворе НС1: / - Fe-5Сг- 12Мо- 18С; 2 - Fe-5Сг-12Мо-20В; 3 - Fe- 5Сг-12МО-13Р-7С; 4-Fe- ЮСг-12Мо-8С; 5-Fe- 1 ОСг- 12Мо-20В. б - Fe- ЮСг-12Мо-I3P-7С Однако при испытаниях на растяжение в водных растворах серной кислоты в случае анодной поляризации прочность сплава не снижается. Кроме того, если образец аморфного сплава предварительно выдержать некоторое время в смешанном растворе серной кислоты и поваренной соли, а затем провести испытание на растяжение на воздухе, прочность в этом случае также не снижается. При такой предварительной выдержке в растворе без нагрузки данный аморфный сплав почти не корродирует и, естественно, отсутствует водородное охрупчивание. Однако, если нагрузку приложить одновременно с погружением образца в сильнокислый водный раствор с определенной концентрацией, например, хлорид ионов, водородное охрупчивание возникает и в случае анодной поляризации. На водородное охрупчивание аморфных сплавов существенно влияют их коррозионная стойкость и содержание металлоидов. На рис. 9.27 показано, как изменяется время до разрушения аморфных сплавов Fe-Сг-Мо в зависимости от величины деформации и времени выдержки в 1 н. водном растворе НС1 [36]. Видно, что время до разрушения значительно увеличивается и коррозионная стойкость сплава повышается при увеличении содержания хрома. Растрескивания при этом нет. В таком растворе, как 1 н. HCI при коррозии происходит реакция (9.5) восстановления ионов водорода Н+ причем восстанавливается только то количество водорода, которое определено по реакции. Соответственно по реакции (9.10) определяется и количество абсорбированного водорода. Если коррозия прекращается, то водород не абсорбируется, и, естественно, водородное охрупчивание отсутствует. Сплавы, содержащие только один металлоид - углерод, в наибольшей степени подвержены водородному охрупчиванию. Напротив, сплавы, содержащие углерод и бор, или углерод и фосфор, трудно поддаются водородному охрупчиванию. Такие сплавы пассивируются в 1 и. водном растворе НС1. Сплавы, содержащие фосфор, имеют очень большую скорость пассивации и почти не корродируют при приложении нагрузки, так как, хотя при растяжении пассивирующая пленка разрушается, она быстро восстанавливает ся за счет повторной пассивации (репассивации). Следовательно и в этих сплавах водородное охрупчивание затруднено. Обычно считают, что фосфор вреден для кристаллических сплавов, так как он ускоряет водородное охрупчивание. Это происходит вследствие того, что фосфор тормозит реакцию (9.7), уменьшающую количество водорода, абсорбирующегося на внешней поверхности металла, другими словами, фосфор ускоряет реакцию (9.10). Однако в аморфных сплавах фосфор предотвращает водородное охрупчивание, так как способствует повышению коррозионной стойкости. Тем не менее, известно, что аморфные сплавы Fe-Р-С, не содержащие второго металлического элемента, наиболее подвержены коррозии среди сплавов типа железо - металлоид и при испытаниях на длительную прочность в воздушной атмосфере эти сплавы корродируют за счет наличия влаги в воздухе, что приводит к их разрушению вследствие водородного охрупчивания [37]. Количество абсорбированного водорода, вызывающее водородное охрупчивание аморфных сплавов, невелико по сравнению с аналогичным количеством водорода для кристаллических сплавов [35];. Вероятно, путем легирования аморфных сплавов такими элементами, как хром, повышающими коррозионную стойкость, а также путем подбора соответствующего типа металлоидных атомов можно полностью устранить водородное охрупчивание. После разрушения аморфных сплавов за счет водородного охрупчивания получаются характерные, очень красивые изломы. Внешний вид этих изломов сильно отличается от вида изломов после разрушения аморфных сплавов на воздухе (см. гл. 8). Ско- рость распространения трещины, рассчитанная по излому, в аморфных сплавах составляет 1200-1400 м/с, т. е. аморфный металлический материал при водородном охрупчивании разрушается за счет практически мгновенного распространения трещины. В заключение этого раздела хотелось бы отметить еще один интересный факт. Аморфный сплав Ni-29Fe-14Р-6В-2А1 при нагружении в 3,5 н. водном растворе NaCl при 26°С до напряжения, составляющего 75% от его предела прочности, разрушается через 117 ч [39]. Этот шлав легко корродирует, так как не содержит хрома. В его изломе частично наблюдается узор, характерный для водородного охрупчивания. Предполагают, что здесь имеет место коррозия под напряжением и разрушение наступает именно вследствие водородного охрупчивания. 9.7. ДРУГИЕ ХИМИЧЕСКИЕ СВОЙСТВА Исследования химических свойств аморфных сплавов, не относящихся к их коррозионному поведению, пока развиваются не слишком интенсивно. Тем не менее, можно ожидать, что особенности химического поведения аморфных металлических материалов, связанные с их высокой химической активностью, будут детально исследованы и, вероятно, уже в недалеком будущем будут найдены их новые интересные химические свойства. В данном разделе мы рассмотрим некоторые свойства аморфных металлов, которых мы уже кратко коснулись в разделах 2 и 3. 9.7.1. Аморфные электродные материалы для электролиза поваренной соли При производстве соды в процессе электролиза NaCl на аноде образуется газообразный хлор, а на катоде-гидрооксид натрия и водород. Поскольку образование газообразного хлора происходит по реакции (9.6) при высоком потенциале, материал анода работает в сильной окислительной среде. Это может вызывать сильную коррозию материала анода, так как в начале процесса концентрация ионов хлора в растворе велика и, кроме того, процесс идет при повышенных температурах. К тому же, поскольку реакция (9.6) образования газообразного хлора в термодинамическом смысле протекает труднее, чем реакция образования газообразного кислорода, т. е. реакция, обратная (9.3), материал анода должен выбираться таким образом, чтобы он, будучи высокоактивным катализатором образования хлора, в то же время был бы пассивен по отношению к образованию газообразного кислорода. В настоящее время при производстве соды используются аноды на основе титана с комбинированным покрытием из оксидов Ru02 и ТЮг. Здесь, однако, применение аморфных сплавов оказывается весьма перспективным, поскольку они обладают высокой каталитической активйостью и коррозионной стойкостью. В такой сильной коррозионной среде в качестве электродных материалов пригодна сплавы, содержащие благородные металлы, однако чистые благородные металлы корродируют интенсивно, что понижает их каталитическую активность по отношению к образованию хлора. Активность благородных металлов по отношению к выделению хлора уменьшается в ряду элементов Pd>Ir>Ru~ =!Pt>Rh, хотя все эти элементы довольно активны по отношению-к выделению кислорода. Быстрой закалкой жидкости наиболее легко получаются сплавы с палладием, при этом они обладают достаточно высокой коррозионной стойкостью в водных раствррах хлоридов при повышенных температурах и являются хорошими катализаторами [19]. На рис. 9.28 приведены кривые анодной поляризации кристаллического палладия и аморфных сплавов Pd-Р и Pd-Si в водном, растворе при комнатной температуре. Поляризационные кривые палладия являются классическим примером анодной поляризации благородных металлов в этой среде. При повышении потенциала начиная от потенциала коррозии обнаруживается большой элект- 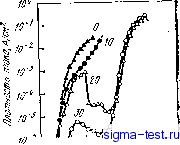 о 0,1 0,1< 0,6 0,8 1,0 1,1 1,i 1,6 ф Поглен1/иа/1в Рис. 9.29. Потеициостатические-поляризационные кривые аморфных сплавов Pd-Rh-19Р в 4iVl растворе NaCl при 80°С [цифры у кривых - концентрация родия,. % (ат.: <J lie. и,Ч Ци щ, ~у .,. ., , ЛотещищО Рис. 9.28. Потенциодинамические кривые анодной поляризации аморфных сплавов Pd-,Si (i) и Pd-Р (2), а также чистого кристаллического палладия (3) в 4 н. водном растворе NaCI (рН4) при комнатной температуре рический ток, соответствующий активному растворению. При дальнейшем повышении потенциала электрический ток при пассивации снижается, а затем при появлении газообразного хлора он снова возрастает. Большой электрический ток в этой области потенциалов обусловлен именно процессом выделения гйзообразного хлора, хотя коррозия также вносит заметный вклад. В случае аморфных сплавов Pd-Р электрический ток активного растворения ниже, чем в случае кристаллического палладия, и в области потенциалов выделения газообразного хлора коррозия не дает вклада в величину тока. Идеальным электродным материалом является такой, в котором активного состояния не возникает вследствие самопассивации и при этом образование газообразного хлора при соответствующем потенциале не сопровождается коррозией. Это имеет место только тогда, когда максимальный ток активного растворения и минимальный ток пассивации малы, а коррозионная стойкость, естественно, велика. Для повышения коррозионной стойкости аморфных сплавов Pd-Р весьма эффективно легирование их элементами подгруппы платины (Rh, Pt, Ir) [40]. На рис. 9.29 показаны кривые анодной поляризации аморфного сплава Pd-Rh-Р при температуре, близкой к 80°С, в применяемом в промышленности для электролиза поваренной соли 4 М водном растворе iNaGl (рН 4). Сплавы, содержащие >20% (ат.) Rh, пассивируются при довольно высоком потенциале, при еще большем потенциале (1,0 В) происходит выделение газообразного хлора и электрический ток быстро возрастает с повышением потенциала. Таким образом, если сплавы палладия, легированные подходящими элементами, аморфизу-ется, то их можно использовать как материалы для электродов, поскольку они соединяют в себе высокую каталитическую активность, способствующую выделению газообразного хлора, и высокую коррозионную стойкость. В случае поляризации при высоких потенциалах в водных растворах поваренной соли обычно трудно что-либо сказать о чистоте получаемого газа, поскбльку кроме хлора образуется еще и кислород. Применяя растворы, не содержащие ионы С1-, можно оценить активность материала в среде при образовании только газообразного кислорода. Были проведены измерения в 1 М водном растворе Na2S04 (рН 4) при 80°С при анодной поляризации, т. е. при тех же температуре и рН, что и в случае 4 М водного раствора NaCl. Далее сравнили значения плотности электрического тока, полученные в этих двух растворах. В табл. 9.1 показано сравнение характеристик применяемых в настоящее время электродов из Ru02/Ti с покрытием из Ru02 и графитовых электродов с характеристиками активности различных аморфных сплавов. Плотность электрического тока в 1 М N82804 в случае аморфных сплавов всегда ниже, чем в случае Ru02/Ti. Это свидетельствует о том, что аморфные сплавы слабо способствуют выделению кислорода. Следовательно, можно предположить, что чистота газообразного хлора, получаемого в случае применения электродов из аморфных сплавов, будет высокая из-за низкого содержания кислорода. Кроме того, некоторые аморфные сплавы, как катализаторы для получения хлора более активны, чем Ru02/Ti. 9.7.2. Катализаторы дпй синтеза этилена Метан, этилен, пропилен и некоторые другие углеводороды можно получить при реакции водорода с оксидом углерода. Пропуская водяной пар через уголь или кокс, нагретый до белого каления, можно получить сырье для последующего органического синтеза, исключающего использование нефти. В качестве катализаторов здесь применяются железо, кобальт и никель. На рис. 9.30 приведены данные, позволяющие сравнить каталитическую активность аморфных сплавов Fe-Ni-Металлоид и кристаллических сплавов такого же химического состава [41], Активность аморфного катализатора в реакциях синтеза при температурах, лежащих несколько ниже температуры кристаллизации аморфного сплава, примерно в 100 раз выше, чем активность кристаллического катализатора того же состава. Даже ленточные амор. фные сплавы, рассмотренные в этой работе, имеющие удельную внешнюю поверхность 1 мм/г, можно с успехом применять в качестве катализаторов. Таблица 9.1. Плотность тока на электродах при поляризации прн 1,15 В в водных растворах с рН 4 при 80 °С Электрод Плотность тока. Д/м О со рные сплавы: Pd-401г-19Р Pd-301г-5Ti-19Р Pd-aoir-lOTi-19Р Pd-30Ir-5Rh-19P Pd-30Ir-5Pt-19P Pd-30Ir-lORu-19P Графит RuOa/Ti 2000 3000 1500 700 860 2200 41 1700 5 2 5 4 17 28 20 340 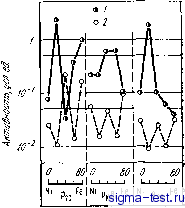 Рнс. 9.30. Изменение каталитической активности аморфных сплавов Fe-Ni - Металлоид в реакциях водорода и СО в завнснмости от химического состава сплава: / - аморфное состояние; 2 - кристаллическое состояние Таким образом, аморфные сплавы имеют превосходные характеристики как катализаторы органического синтеза. В результате исследований в этом направлении, вероятно, появятся,новые великолепные материалы. 9.7.3. Материалы для топливных элементов, работающих на метаноле Топливные элементы представляют собой устройства типа гальванических элементов, в которых химическая энергия, освобождающаяся при окислении топлива, непрерывно преобразуется непосредственно в электрическую энергию. Предполагают, что такие гальванические элементы, обладающие весьма высоким коэф.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© 2010 www.sigma-test.ru Санкт-Петербург: +7 (812) 265-34-48, +7 (812) 567-94-10
Разработка и поддержка сайта: +7(495)795-01-39 после гудка 148651, sigma-test.ru(my_love_dog)r01-service.ru Копирование текстовой и графической информации разрешено при наличии ссылки. |